公众对科研的认识不出意外应该就是下图这样的,首先有一个idea,然后接收挑战,看看文献,做做实验,最后就能发一篇满意的paper走上人生巅峰了!

图1. 公众对科研的认识(创意来源:Paul Vallett 图片来源:伯小远)
该过程堪称完美,绝对是每一个科研人梦寐以求的事情!因为,实际的科研过程是下图这样的,额...由于该过程实在太过复杂,伯小远实在不知该如何解释,总的来说就是过程艰辛,最后可能还是一场空,心已千疮百孔,但仍要面对惨淡的人生!
图2. 实际的科研(创意来源:Paul Vallett 图片来源:伯小远)
咱言归正传,前面的开场看似跑的有点远,其实伯小远也是用心良苦啊,通过上面的引入就想告诉大家,做科研真的不容易啊,为什么不容易呢?做基因功能验证的小伙伴肯定都有过这样的苦恼,为什么做了转基因和预期的不一致?小伙伴们肯定有很多疑问,明明转入的基因是由一个高表达的启动子启动的,可为什么就是检测不到应有的表达呢?还有把一个基因敲除和敲低,得到的结果却相反?明明是组成型启动子驱动的绿色荧光蛋白(Green Fluorescent Protein,GFP),可为什么并不是所有部位都能检测到GFP荧光信号呢?伯小远通过大量的资料收集,为大家总结了下面的一些干货,希望能对大家的科研有所帮助!
转基因是现代生物学中研究基因功能以及开发生物产品不可或缺的重要技术。与内源基因相比,转入的外源基因经常会受到小RNA(small RNAs, sRNA)的介导,产生基因沉默而不能正常表达。那么什么是sRNA介导的基因沉默?
sRNAs通常分为microRNAs(miRNAs)和小干扰RNA(small interfering RNA, siRNA),sRNA介导的基因沉默在植物基因表达调控中发挥着核心作用。其过程如下:双链RNA(double stranded RNA,dsRNA)通过DICER LIKE (DCL)酶的作用,被加工成21-24 nt的sRNAs,这些sRNAs被加载到ARGONAUTE (AGO)蛋白质中,形成RNA诱导沉默复合物(RNA-induced silencing complex,RISC)。RISC介导的基因下调可能以转录基因沉默(Transcriptional gene silencing,TGS)或转录后基因沉默(Post-transcriptional gene silencing,PTGS)的形式发生。在第一种情况下,RISC活性导致靶区甲基化或染色质缩合,导致mRNA合成减少,从而使得基因表达下调。在PTGS中,最常见的结果是sRNA引导的靶点被AGO切割,导致转录消失。另外,RISC也可以诱导翻译抑制(Bologna and Voinnet, 2014)。
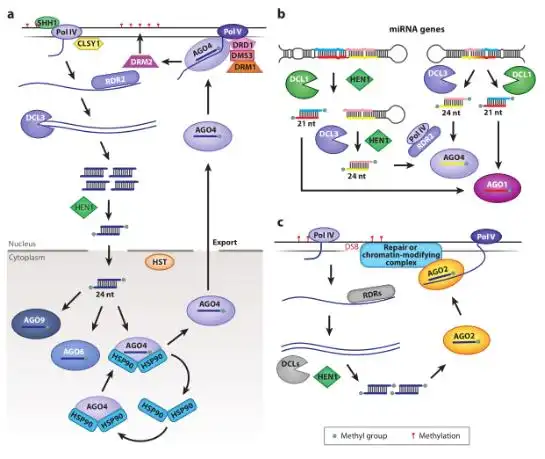
图3. 转录基因沉默相关的sRNA途径
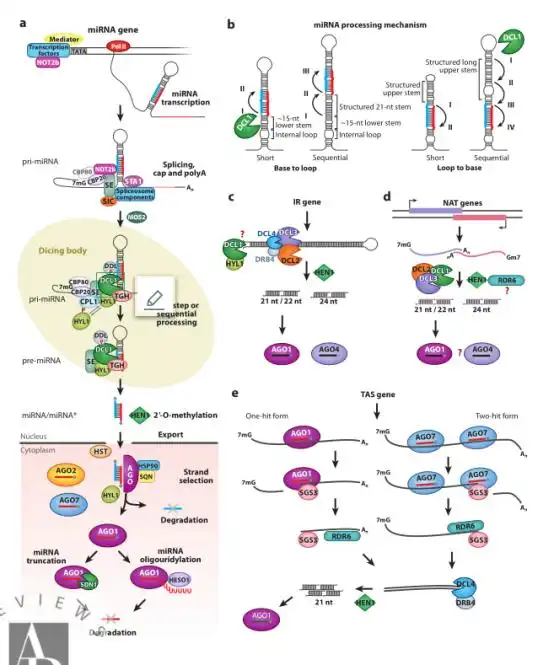
图4. 转录后基因沉默相关的sRNA通路
人们针对转基因不表达的问题曾提出了不同的见解。例如,有研究表明表达强度是影响转基因触发siRNAs数量的因素(Que et al., 1997; Bleys, Van Houdt, et al., 2006)。这一现象可能是由于强组成性启动子被用来驱动基因表达,导致了异常分子数量的增加,如mRNA丢失了poly(A)尾,进而导致缺失poly(A)的mRNA被RDR6招募(Luo and Z., Chen, 2007; Baeg et al., 2017)。
很多人肯定会疑惑突然出现的RDR6是什么,放心,伯小远绝不会让大家带着疑惑读文章的,下面就是它的解释说明啦!
植物细胞中dsRNA的一个重要来源是通过RNA依赖的RNA聚合酶(RNA-dependent RNA polymerases,RDRs)的作用,将单链RNA(single stranded RNA,ssRNA)转化为dsRNA。而植物中一个重要的RDRs就是RDR6,它参与了几种内源性调控siRNAs以及病毒和其他外源序列衍生的sRNAs的产生。
另一个经常被用来解释转基因沉默的原因是它们与原核基因的相似性。例如,许多在植物中常用的驱动转基因的调控序列,如花椰菜花叶病毒(CaMV)35S启动子或来自农杆菌OCTOPINE SYNTHASE(OCS)基因的终止子,是外源序列,并被认为含有有利于siRNA产生的特性。此外,转基因中经常缺乏内含子,而内含子是真核生物基因中的一种常见元素。有研究表面,在植物调控区域的控制下表达并含有内含子的内基因重组转基因被证明对PTGS具有更强的抗性(Dadami et al., 2013)。同样,剪接也会影响基因稳定性和转基因siRNA的积累(Christie et al., 2011)。最后,使用一些终止子,如拟南芥HEAT SHOCK PROTEIN18.2基因的3’调控元件,会使得转基因产生更高的表达以及提高mRNA的稳定性,同时降低TGS的易感性(Nagaya et al., 2009; Hirai et al., 2011; Pérez-González and Caro, 2018)。然而,之前的这些研究一次只关注一个或几个方面,不同的基因组元件在保护基因免受沉默机制的相关贡献及其分子机制尚不清楚。近期,昆士兰科技大学的Peter M. Waterhouse研究组在Plant Journal上发表题为”The key role of terminators on the expression and post-transcriptional gene silencing of transgenes“的研究论文,本文作者通过EMS诱变筛选和报告基因系统的方法分析揭示了基因终止子和转录终止机制参与了保护转入基因免于沉默的分子机制,结合之前涉及到的与转基因不稳定性有关的不同遗传元件,系统地测试了这些这些因素中的多个方面,结果发现基因终止子序列对转基因衍生的sRNA积累的影响最大,某些内含子/终止子的组合可能会通过干扰转入基因的剪接导致sRNA产量增加。具体的结果分析大家可以自己去阅读文献哦,这里伯小远就不花篇幅去解读结果了哟!
上面对转基因过程中出现的基因沉默现象给出了解释,特别是对过表达具有指导性的意义,为了防止自己在以后的实验过程中再出现转基因没表型的情况发生,在构建载体时可以先考虑一下自己载体上各种调控元件是否为最优组合。
基因敲除和基因敲低也是研究基因功能常用的手段,但很多时候会观察到基因敲除和基因敲低具有相反的表型,遇到这种情况不知道正在做实验的你会是什么反应呢?
基因补偿反应(Genetic compensation response,GCR)被提出可能是解释基因敲除和基因敲低之间表型差异的原因,2019年4月4日,Nature在线分别发表了浙江大学陈军教授课题组和Stainier教授课题组的研究成果,揭示了遗传补偿效应的分子机制。
陈军、彭金荣老师研究组首先针对capn3a和nid1a两个基因,用一系列漂亮的突变体结合转基因斑马鱼系证明了基因突变导致的GCR是依赖于突变所造成的蛋白翻译未成熟提前终止信号(premature termination codon,PTC),这种提前终止会导致突变基因的同源基因上调,从而导致敲低capn3a导致的肝脏变小以及nid1a敲低所导致的体长变短两个表型在其各自的突变体中消失;进一步的研究证明该补偿机制依赖于Upf3a蛋白介导的一种存在于真核生物中重要的RNA监控机制-“无义介导的mRNA降解”信号通路(nonsense-mediated mRNA decay,NMD),但并不依赖于同样参与NMD的Upf1和Upf3b,有意思的是,Upf3a介导的基因代偿,并非使突变mRNA降解,相反的,是保护其不被降解(这与同期发表的另一篇文章的机制正好相反);陈、彭研究组进一步证明,Upf3a诱导遗传补偿的机制是其与COMPASS复合体结合,从而增加相关同源基因在转录起始位点附近的H3K4三甲基化水平,而最终使这些基因的转录水平上调(图5),而被保护的突变基因可能起到识别、并招募Upf3a及COMPASS复合体至其同源基因转录起始位点附近的作用。
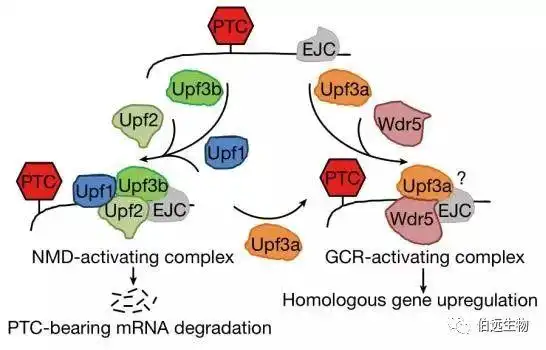
图5. 遗传机制补偿模型
另一篇文章利用斑马鱼和小鼠模型,同样阐明了PTC介导的依赖于NMD的基因代偿机制,同样需要COMPASS介导的H3K4三甲基化参与,最大的不同是,Stainier组所阐述的机制依赖于突变mRNA的降解,而不是保护(图6),可能的原因是否是因为不同的组织所利用的遗传代偿机制有所不同?(前一篇文章两个基因分别影响肝脏和体长发育,后一篇文章主要关注了细胞的形态和斑马鱼血管)
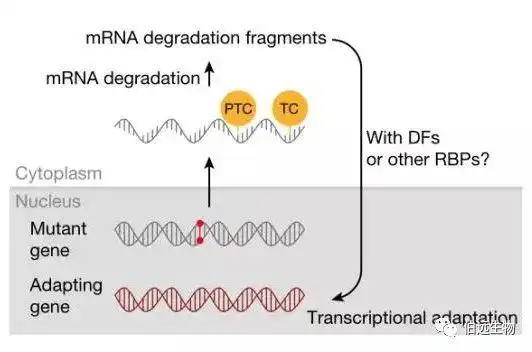
图6. 目前假定的转录适应突变的简化模型
这两篇文章解决了困扰很多研究组的一个难题,为辛辛苦苦获得了突变体而发现表型没了的实验室重新带来了希望!
组成型启动子理论上在任何部位都能表达,但是实际情况也会有偏差,原因是什么呢?下面的是一篇研究论文的结果,看完肯定会对你所有启发!
CaMV 35S启动子是植物中最常用的驱动转基因表达的启动子。虽然它被认为是一个组成性启动子,但一些报道表明它并没有在所有的细胞类型中表达。此外,关于其在所有可能的细胞和组织类型以及在发育早期阶段的表达谱的可用信息是不完整的。早前有研究以GFP基因作为报告系统,研究了该启动子在棉花胚胎发育过程中以及在所有营养细胞和花细胞和组织类型中的表达情况。在胚胎发生的早期没有检测到GFP的表达。大约在开花期后13天左右,在胚胎的下胚轴与子叶交界处的一小块区域第一次观察到可察觉的GFP表达。随着胚胎发育的进展,GFP荧光逐渐增强并扩展到整个子叶和下胚轴。萌发后,下胚轴、子叶、茎、叶、叶柄和根的所有细胞和组织类型的启动子活性均有不同程度的变化。该启动子在所有花区均有表达。尽管棉花花粉表现出较低水平的绿色自发荧光,但在所有T0植株的部分花粉中,仍可以分辨出GFP依赖的荧光。发育中的棉纤维也显示出GFP荧光,表明35S启动子在这些特化的表皮细胞中具有活性。最终的研究结果表明,35S启动子的表达在胚胎发生过程中受到发育调控,在胚胎发生的某一阶段之后,该启动子在棉花大多数细胞和组织类型中表达,尽管表达水平不同(Sunilkumar et al., 2002)。
最后,根据本公司多年的实验经验,发现NOS启动子启动真核基因在单子叶植物(目前主要是水稻)中的表达其结题率不到30%,而其它项目的结题率一般都在95%以上,那么是否是因为NOS启动子不适用于单子叶植物的转基因,还是所有植物都不太适合,其背后的分子机制是什么?不知这个现象是否能够给大家科研提供一个很好的idea呢?
讲到这里,公众应该也能明白,科研为啥没有没有想象的那么容易了,对于科研过程中出现的问题,有的已经研究出了背后的机制,但这毕竟是少数,在实际的科研过程中,还有大量的难题是我们无法解释的!用一句话形容科研生活特别贴切:过完了最累的今天,还有更累的明天!不知做科研的你是否也有过这样的感受呢!但不论怎样,伯远生物将是你最坚强的后盾,陪你一路披荆斩棘,为你排忧解难,并助你一臂之力!
伯远生物为了缓解你在科研生活中的压力,在今年秋天决定,以后会不定期推送开心一刻的小推文哦!敬请关注伯远生物公众号,让科研更有趣!
References:
Annick Bleys, Leen Vermeersch, Helena Van Houdt, and Anna Depicker. The frequency and efficiency of endogene suppression by transitive silencing signals is influenced by the length of sequence homology . Plant Physiology, 2006, 142(2):788-796.
Chen L Z . Improperly Terminated, Unpolyadenylated mRNA of Sense Transgene Is Targeted by RDR6-Mediated RNA Silencing in Arabidopsis . The Plant Cell, 2007, 19(3):943-958.
Christie M , Croft L J , Carroll B J . Intron splicing suppresses RNA silencing in Arabidopsis . Plant Journal, 2011, 68(1):159–167.
Dadami E , Moser M , Zwiebel M , et al. An endogene-resembling transgene delays the onset of silencing and limits siRNA accumulation . Febs Letters, 2013, 587(6):706-710.
Hirai T , Kurokawa N , Duhita N , et al. The HSP terminator of Arabidopsis thaliana induces a high level of miraculin accumulation in transgenic tomatoes . Journal of Agricultural & Food Chemistry, 2011, 59(18):9942-9.
Kyungmin, Baeg, Hiro-Oki, et al. The poly (A) tail blocks RDR6 from converting self mRNAs into substrates for gene silencing . Nature Plants, 2017.
Ma Z , Zhu P , Shi H , et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components . Nature, 2019, 568(7751):1-5.
Nagaya S , Kawamura K , Shinmyo A , et al. The HSP Terminator of Arabidopsis thaliana Increases Gene Expression in Plant Cells . Plant & Cell Physiology, 2010, 51(2):328-332.
NG Bologna, O Voinnet. The diversity, biogenesis, and activities of endogenous silencing small RNAs in Arabidopsis . Annual Review of Plant Biology, 2014, 65(1):473-503.
Pérez-González Ana, Elena C.Effect of transcription terminator usage on the establishment of transgene transcriptional gene silencing . Bmc Research Notes, 2018, 11(1):511.
Premature Nonsense Codons in the Transgene Coding Sequence . Plant Cell Online, 1997, 9(8):1357-1368.
Que, Q. The Frequency and Degree of Cosuppression by Sense Chalcone Synthase Transgenes Are Dependent on Transgene Promoter Strength and Are Reduced by
Sunilkumar G , Mohr L A , Lopata-Finch E , et al. Developmental and tissue-specific expression of CaMV35S promoter in cotton as revealed by GFP . Plant Molecular Biology, 2002, 50(3):463-474.
